√ Pola Soal Dan Pembahasan Reaksi Kesetimbangan
Contoh Soal Dan Pembahasan Reaksi Kesetimbangan
style="display:block"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="5411244982"
data-ad-format="link"
data-full-width-responsive="true">
PEMBAHASAN :
reaksi yang berlangsung searah (berkesudahan) yaitu reaksi kimia di mana zat-zat hasil reaksi tidak sanggup saling bereaksi kembali menjadi zat pereaksi misalnya :
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Sedangkan reaksi sanggup balik (bolak-balik) yaitu reaksi kimia di mana zat-zat hasil reaksi sanggup saling bereaksi kembali menjadi zat pereaksi, contohnya:
PbSO4(s) + 2NaI(aq) ⇔ PbI2(s) + Na2SO4(aq)
PEMBAHASAN :
Reaksi kesetimbangan yaitu reaksi dimana komponen zat-zat pereaksi dan zat hasil reaksi tetap ada dalam sistem, dalam keadaaan setimbang laju reaksi ke kanan sama dengan laju reaksi ke kiri.
syarat-syarat biar sanggup menjadi reaksi setimbang:
1. Reaksi bolak-balik
2. Sistem tertutup
3. Bersifat dinamis
LIHAT JUGA : Rangkuman Materi Reaksi Kesetimbangan
PEMBAHASAN :
Karena produk sanggup bereaksi kembali membentuk pereaksi. Dalam keadaan setimbang dinamis laju ke produk sama dengan ke perekaksi sehingga pereaksi tidak akan habis
LIHAT JUGA : Video Pembelajaran Reaksi Kesetimbangan
3A2 + 2B2 ⇔ 2A3B2
Pada ketika kesetimbangan tercapai, zat A2 telah bereaksi sebanyak 1 mol. Tentukan komposisi masing-masing zat pada keadaan setimbang
PEMBAHASAN :
Reaksi : 3A2 + 2B2 ⇔ 2A3B2
M 2 3 –
R 1 2/3 – 2/3 +
S 1 7/3 2/3
Jadi mol dalam keaadaan setimbang
A2 = 1 mol
B2 = 7/3 mol
A3B2 = 2/3 mol
LIHAT JUGA : Contoh Soal Reaksi Kesetimbangan Bagian II
N2(g) + 3H2(g) ⇔ 2NH3(g)
Pada ketika kesetimbangan tercapai, volume sistem menjadi 40 mL. Jika volume diukur pada suhu dan tekanan yang sama, tentukan komposisi (volume masing-masing gas) pada ketika kesetimbangan
PEMBAHASAN :
Reaksi : N2(g) + 3H2(g) ⇔ 2NH3(g)
M 20 25 –
R 1/2 x 3/2 x – x +
S 20-1/2x 25 – 3/2x x
volume total = 40 L = 20 – 1/2x + 25 – 3/2x + x
40 = 45 – x
x = 45 – 40
x = 5
volume dalam keadaan setimbang:
N2 = 20 – 1/2(5) = 17,5 L
H2 = 25 – 3/2x = 25 – 3/2(5) = 17,5 L
NH3 = 5 L
DOWNLOAD CONTOH SOAL REAKSI KESETIMBANGAN DALAM BENTUK PDF KLIK DISINI
style="display:block; text-align:center;"
data-ad-layout="in-article"
data-ad-format="fluid"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="8126346735">
a. PCl5(g) ↔ PCl3(g) + Cl2(g)
b. 2SO3(g) + 2Cl2(g) ↔ 2SO2Cl2(g) + O2(g)
c. CO(g) + 2H2(g) ↔ CH3OH(g)
d. Cu2+(aq) + Zn(s) ↔ Zn2+(aq) + Cu(s)
e. 2NH3(g) + CO2(g) ↔ NH2CO2NH4(s)
PEMBAHASAN :
style="display:block; text-align:center;"
data-ad-layout="in-article"
data-ad-format="fluid"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="8126346735">
2N2(g) + O2(g) ⇔ 2N2O(g)
Jika pada ketika tercapai kesetimbangan terdapat 0,3 mol gas nitrogen, hitunglah nilai tetapan kesetimbangannya
PEMBAHASAN :
Reaksi : 2N2(g) + O2(g) ⇔ 2N2O(g)
M 0,5 0,5 –
R 0,2 0,1 – 0,2 +
S 0,3 0,4 0,2
H2(g) + I2(g) ↔ 2HI(g)
pada To yaitu 4. Tentukan tetapan kesetimbangan (K) bagi reaksi:
HI(g) ↔ 1/2 H2(g) + 1/2 I2(g)
PEMBAHASAN :
Reaksi yang ditanyakan merupakan reaksi yang diketahui yang di balik dan di bagi 2.
jika reaksi dibalik maka Kbaru = 1/Klama
jika dibagi x maka K gres = 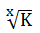
maka K gres = 
PCl5(g) ↔ PCl3(g) + Cl2(g)
Tentukan niai tetapan kesetimbangan bagi reaksi tersebut pada ToC
PEMBAHASAN :
CO(g) + 1/2 O2 ↔ CO2(g) K = 1,1 x 1011
H2O(g) ↔ H2(g) + 1/2 O2(g) K = 7,1 x 10-12
Tentukan nilai tetapan kesetimbangan (K) pada suhu 1.000 K untuk reaksi:
CO(g) + H2O(g) ↔ CO2(g) + H2(g)
PEMBAHASAN :
kedua reaksi dijumlahkan:
CO(g) + 1/2 O2 ↔ CO2(g) K1 = 1,1 x 1011
H2O(g) ↔ H2(g) + 1/2 O2(g) K2 = 7,1 x 10-12
zat yang ada di bab kiri dan kanan sanggup di coret, sehingga penjumlahan kedua reaksi menghasilkan reksi:
CO(g) + H2O(g) ↔ CO2(g) + H2(g) dengan K = K1 x K2 = 1,1 x 1011 x 7,1 x 10-12 = 7,81 x 10-1
A(g) + B(g) ↔ 2C(g) + D(g)
Terdapat 2 mol gas A, 3 mol gas B, 4 mol gas C, dan 2 mol gas D. Tekanan ruangan pada kesetimbangan yaitu 2,2 atm. Hitunglah nilai Kp untuk kesetimbangan tersebut
PEMBAHASAN :
Menentukan tekanan parsial masing-masing zat
Menentukan Kp
N2(g) + 3H2(g) ↔ 2NH3(g)
Ternyata pada ketika setimbang terdapat gas N2 sebanyak 0,25 mol. Hitunglah Kp dan Kc pada ketika itu
PEMBAHASAN :
Reaksi N2(g) + 3H2(g) ↔ 2NH3(g)
M 0,5 1,5 –
R 0,25 0,75 – 0,5 +
S 0,25 0,75 0,5
NH4Cl(s) ↔ NH3(g) + HCl(g)
Pada ketika setimbang terdapat 0,5 mol gas HCl dan tekanan ruangan pada ketika itu yaitu 5 atm, hitunglah nilai Kp kesetimbangan tersebut.
PEMBAHASAN :
Reaksi NH4Cl(s) ↔ NH3(g) + HCl(g)
M x – –
R 0,5 0,5 – 0,5 +
S x-0,5 0,5 0,5
N2(g) + 3H2 ↔ 2NH3(g)
pada 400 K mempunyai nilai Kp = 100. Hitunglah nilai Kc untuk kesetimbangan tersebut
PEMBAHASAN :
style="display:block; text-align:center;"
data-ad-layout="in-article"
data-ad-format="fluid"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="8126346735">
2SO2(g) + O2(g) ↔ 2SO3(g) Kp = 6,7 x 104
Jika tekanan parsial gas SO2 = 1,2 atm; gas O2 = 3,4 atm; dan gas SO3 = 4 atm, selidikilah apakah sistem tersebut sudah dalam keadaan setimbang atau belum
PEMBAHASAN :
Karena Qp ≠ Kp maka sistem tersebut belum dalam keadaan setimbang
2SO3(g) ↔ 2SO2(g) + O2(g)
Setelah terjadi kesetimbangan ternyata di dalam sistem terdapat 0,1 mol gas oksigen. Hitunglah nilai derajat disosiasinya (α)
PEMBAHASAN :
Reaksi: 2SO3(g) ↔ 2SO2(g) + O2(g)
M 0,5 – –
R 0,2 – 0,2 0,1 +
S 0,3 0,2 0,1
PEMBAHASAN :
Reaksi : 2NO2(g) ↔ 2NO(g) + O2(g)
M 2 – –
R 0,8 – 0,8 0,4 +
S 1,2 0,8 0,4
2NH3(g) ↔ 2NH2(g) + H2(g)
Jika derajat disosiasi, α = 0,2; hitunglah nilai tetapan kesetimbangannya (Kc)
PEMBAHASAN :
mol reaksi = α x mol mula-mula = 0,2 x 0,1 = 0,02 mol
Reaksi : 2NH3(g) ↔ 2NH2(g) + H2
M 0,1 – –
R 0,02 – 0,02 0,01 +
S 0,08 0,02 0,01
CH3COOH(aq) ↔ CH3COO–(aq) + H+(aq)
dengan derajat disosiasi, α = 0,1. Hitunglah konsentrasi ion H+ di dalam larutan.
PEMBAHASAN :
Molaritas reaksi = α x molaritas mula-mula = 0,1 x 0,1 = 0,01 M
Reaksi: CH3COOH(aq) ↔ CH3COO–(aq) + H+(aq)
M 0,1 – –
R 0,01 – 0,01 0,01 +
S 0,09 0,01 0,01
maka konsentrasi ion H+ dalam larutan yaitu 0,01 M
CaCO3(s) ↔ CaO(s) + CO2(g)
Volume CO2 yang terdapat pada ketika setimbang yaitu 22,4 mL. hitunglah derajat disosiasi (α) dan nilai tetapan kesetimbangan (Kp).
PEMBAHASAN :
menentukan mol CaCO3
mol = Gr/Mr = 5 gr/100 = 0,05 mol
menentukan mol CO2
jika dilakukan pada P = 1 atm, maka:
Reaksi : CaCO3(s) ↔ CaO(s) + CO2(g)
M 0,05 – –
R 0,00039 – 0,00039 0,00039+
S 0,0496 0,00039 0,00039
Menentukan α
Menentukan Kp
a. 4NH3(g) + 5O2(g) ↔ 4NO(g) + 6H2O(g)
b. N2(g) + O2(g) ↔ 2NO(g)
PEMBAHASAN :
Jika tekanan dinaikan maka akan bergeser ke jumlah koefisien yang lebih kecil
a. Reaksi akan bergeser ke kiri alasannya yaitu bab kiri mempunyai jumlah koefisien yang lebih kecil
b. tekanan tidak akan menggeser reaksi alasannya yaitu kedua bab mempunyai koefisien yang sama
Fe2O3(s) + 3CO(g) ⇔ 2Fe(s) + 3CO2(g) ΔH = +24,8 kJ
Bagaimanakah besi yang dihasilkan jika:
a.tekanan diperbesar,
b. volume ruangan diperbesar,
c. ditambah Fe2O3,
d. konsentrasi gas CO diperbesar
PEMBAHASAN :
a. tekanan diperbesar akan menggeser ke reaksi dengan jumlah koefisien yang kecil (wujud gas), alasannya yaitu yang berwujud gas di kedua sisi sama jumlah koefisiennya, maka tekanan tidak menghipnotis reaksi kesetimbangan
b. volume diperbesar akan menggeser ke reaksi dengan jumlah koefisien yang besar (wujud gas), alasannya yaitu yang berwujud gas di kedua sisi sama jumlah koefisiennya, maka volume tidak menghipnotis reaksi kesetimbangan
c. alasannya yaitu Fe2O3 berwujud padat maka tidak akan menggeser reaksi kesetimbangan
d. konsentrasi gas CO diperbesar maka reaksi akan bergeser ke kanan atau menjauhi zat yang ditambah konsentrasinya
A(g) ⇔ 2B(g)
diperoleh data eksperimen konsentrasi A dan B pada ketika setimbang di aneka macam suhu sebagai berikut:

Dari data tersebut hitunglah nilai Kp untuk setiap suhu, lalu jelaskan apakah reaksinya eksoterm atau endoterm
PEMBAHASAN :
Karena dengan naiknya suhu nilai K semakin kecil artinya dengan naiknya suhu reaksi bergeser ke kiri. Agar reaksi bergeser ke kanan maka suhu harus diturunkan atau reaksinya Eksoterm
CO2(g) + H2(g) ⇔ CO(g) + H2O(g)
Pada suhu ToC terdapat dalam kesetimbangan gas CO2 dan gas H2 masing-masing 2 mol serta gas CO dan uap air masing-masing 4 mol. Pada suhu yang tetap ditambahkan 4 mol gas CO2 dan 4 mol gas H2. Bagaimanakah komposisi setelah tercapai kesetimbangan yang baru
PEMBAHASAN :
Untuk suhu tetap nilai K tidak berubah atau K1 = K2
mol CO2 sehabis ditambah = 6 mol
mol H2 sehabis ditambah = 6 mol
karena yang ditambah dibagian kiri maka reaksi akan bergeser ke kanan
Reaksi: CO2(g) + H2(g) ⇔ CO(g) + H2O(g)
M 6 6 4 4
R x x – x x +
S (6-x) (6-x) (4+x) (4+x)
Sumber Soal : Kelas XI Penerbit Erlangga Pengarang Unggul Sudarmo
DOWNLOAD CONTOH SOAL REAKSI KESETIMBANGAN DALAM BENTUK PDF KLIK DISINI
style="display:block"
data-ad-client="ca-pub-7930840207405626"
data-ad-slot="5411244982"
data-ad-format="link"
data-full-width-responsive="true">
Sumber aciknadzirah.blogspot.com
0 Response to "√ Pola Soal Dan Pembahasan Reaksi Kesetimbangan"
Posting Komentar